5月7日,FDA宣布批準Jacobus Pharmaceutical公司開發的Ruzurgi(amifampridine)藥片上市,用于治療6-17歲的Lambert-Eaton肌無力綜合征(LEMS)患者。這是FDA批準的第一款針對兒科LEMS患者的新藥。
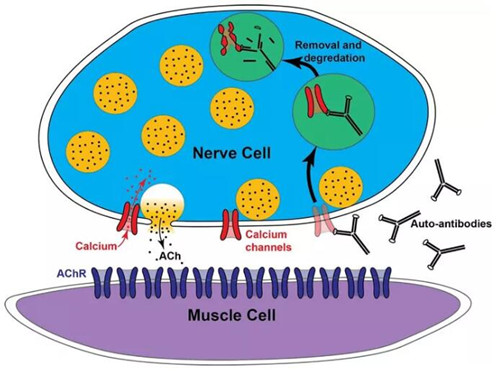
LEMS是一種罕見的自身免疫性疾病,它影響神經和肌肉之間的連接,導致患者出現肌無力和其它癥狀。LEMS患者的自身免疫系統攻擊神經肌肉接頭(neuromuscular junction, NMJ),阻斷神經信號傳導到肌肉細胞中。LEMS可能與其它自身免疫性疾病相關,但是在癌癥患者中更為常見,例如小細胞肺癌患者。
Ruzurgi的活性成分是3,4-二氨基吡啶(3,4-DAP)。它可以阻斷神經突觸前鉀離子通道的活性,從而延長動作電位,提高突觸前鈣離子濃度,導致更多乙酰膽堿釋放,從而增強對肌肉的刺激,緩解LEMS的癥狀。
Ruzurgi的批準是基于成人LEMS患者的臨床試驗,成人患者的藥代動力學數據,以及使用藥代動力學模型和模擬發現的兒科患者劑量,和從6-17歲兒科患者中獲得的安全性數據。
Ruzurgi的療效是基于包含32名成人患者的隨機雙盲,含安慰劑對照的臨床研究。這項研究中,患者先使用Ruzurgi三個月,然后一部分患者持續使用Ruzurgi,而另一部分患者換為接受安慰劑治療。試驗結果表明,繼續接受Ruzurgi治療患者的運動能力減弱程度小于安慰劑組。
“我們將繼續促進治療罕見病,特別是兒科罕見病的療法的開發和批準,”FDA藥物評估和研究中心神經病產品部主任Billy Dunn博士說:“這一批準為LEMS兒科患者帶來了一款他們繼續的治療選擇。這些患者往往因為肌無力和疲憊,很難完成日常活動。”
參考資料:
[1] FDA approves first treatment for children with Lambert-Eaton myasthenic syndrome, a rare autoimmune disorderhttps://www.fda.gov/news-events/press-announcements/fda-approves-first-treatment-children-lambert-eaton-myasthenic-syndrome-rare-autoimmune-disorder